Nowotwór złośliwy, oprócz komórek nowotworowych, składa się z wielu innych rodzajów komórek: podścieliska, naczyń krwionośnych, a także licznych komórek układu odpornościowego, które wspólnie nazywane są mikrośrodowiskiem nowotworu.
Komórki odpornościowe naciekające guz w zróżnicowany sposób wpływają na jego rozwój. Niektóre z nich, tak jak cytotoksyczne limfocyty T lub komórki NK (ang. Natural Killers), zdolne są do zabijania komórek nowotworowych, inne, jak np. mieloidalne komórki supresorowe (ang. myeloid-derived suppressor cells, MDSC), oraz limfocyty regulatorowe (Treg), sprzyjają rozwojowi nowotworu. Układ odpornościowy jest zdolny do rozpoznania nowotworu i wywołania odpowiedzi przeciwnowotworowej, która, niestety, jest najczęściej zbyt słaba, żeby wyeliminować nowotwór. W ciągu ostatnich kilku lat naukowcy nie tylko zidentyfikowali mechanizmy ucieczki komórek nowotworowych spod kontroli układu odpornościowego, ale także, poprzez zablokowanie tych mechanizmów, opracowali nowe strategie walki z nowotworem.
PUNKTY KONTROLNE UKŁADU ODPORNOŚCIOWEGO
Jednym z głównych mechanizmów unikania odpowiedzi immunologicznej przez komórki nowotworowe jest indukowanie immunosupresyjnego środowiska w guzie. Odbywa się to na wiele sposobów, a jednym z głównych mechanizmów jest aktywacja receptorów hamujących, tzw. punktów kontrolnych odpowiedzi immunologicznej, na limfocytach T. Limfocyty T są kluczowymi komórkami zdolnymi do rozpoznania i zabicia komórek nowotworowych. Aktywność limfocytów T jest ściśle regulowana, m.in. poprzez aktywację hamujących punktów kontrolnych obecnych na ich powierzchni, takich jak receptor PD-1 czy CTLA-4. Aktywacja tych receptorów odbywa się po połączeniu z odpowiednimi ligandami białkowymi, zlokalizowanymi na komórkach nowotworowych lub innych komórkach obecnych w mikrośrodowisku guza. Uniemożliwienie oddziaływania pomiędzy hamującymi punktami kontrolnymi oraz ich ligandami powoduje odblokowanie aktywności limfocytów T i prowadzi do niszczenia komórek nowotworowych. Dzięki nadzwyczajnej skuteczności klinicznej przeciwciał monoklonalnych blokujących receptory PD-1 i CTLA-4, w roku 2013 immunoterapia nowotworów została uznana za najbardziej przełomowe odkrycie w dziedzinie medycyny. Co niezwykle istotne, przeciwciała te wykazywały skuteczność również w zaawansowanych postaciach nowotworów. Obecnie, przeciwciała monoklonalne przeciwko PD-1, PD-L1 i CTLA-4 są już zarejestrowane do leczenia zaawansowanych postaci różnych guzów litych. Trwają badania kliniczne testujące skuteczność tych i innych przeciwciał monoklonalnych rozpoznających punkty kontrolne w leczeniu nowotworów litych i hematologicznych. Blokowanie aktywności limfocytów T poprzez aktywację punktów kontrolnych oraz hamowanie tego procesu za pomocą przeciwciał monoklonalnych przedstawiono na poniższej grafice:
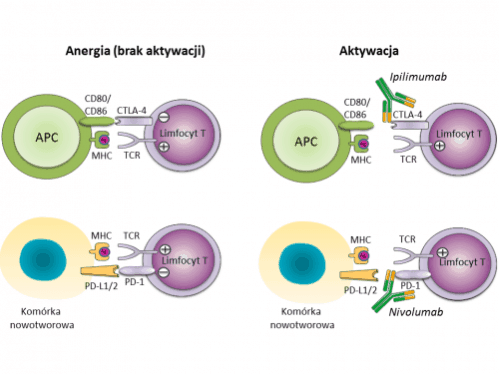
Ryc. 1 Zahamowanie aktywności limfocytów T poprzez punkty kontrolne oraz ich reaktywacja po związaniu przeciwciał monoklonalnych (ipilimumabu i nivolumabu) z receptorami CTLA-4 i PD-1. Skróty: Ag: antygen; APC – komórka prezentujaca antygen (ang. antigen presenting cell); CD80/CD86: cząsteczki ko-stymulujące, ligandy receptora CTLA-4; PD-L1/2: ligandy receptora PD-1.
ENZYMY DEGRADUJĄCE AMINOKWASY
Ogromny sukces kliniczny inhibitorów punktów kontrolnych odpowiedzi immunologicznej nie oznacza jednak, że są to leki skutecznie działające u wszystkich chorych na nowotwór. Badania wykazały, że 20-25 % pacjentów odpowiada na mono-terapię za pomocą tych przeciwciał w stopniu zapewniającym długotrwałe efekty, czyli znaczne wydłużenie całkowitego przeżycia i zahamowanie nawrotu choroby. Obserwacje te przyczyniły się do rozwoju badań mających na celu lepsze, bardziej kompleksowe zrozumienie mechanizmów immunosupresyjnych w środowisku guza. Celem tych badań jest opracowanie jeszcze skuteczniejszych terapii przeciwnowotworowych, celujących jednocześnie w kilka mechanizmów immunosupresyjnych.
Głównymi mechanizmami ucieczki nowotworu spod nadzoru immunologicznego są: 1) przyciągnięcie do mikrośrodowiska guza komórek o działaniu immunosupresyjnym, takich jak limfocyty Treg czy MDSC (patrz wyżej), 2) zmniejszenie ekspresji cząsteczek prezentujących antygeny (ang. major histocompatibility complex, MHC) i blokowanie funkcji komórek prezentujących antygeny, 3) wytwarzanie czynników immunosupresyjnych takich jak cytokiny, chemokiny lub enzymy. W ostatnich latach to właśnie enzymy zmieniające równowagę metaboliczną w mikrośrodowisku guza są tematem intensywnych badań.
Jednym z takich enzymów jest arginaza-1 (ARG-1). ARG-1 bierze udział w rozkładzie jednego z względnie egzogennych aminokwasów – argininy – do ornityny i mocznika, zmniejszając stężenie argininy w środowisku guza. Arginina jest niezbędna do proliferacji (podziałów) limfocytów T i ich aktywności cytotoksycznej względem komórek nowotworowych. Usunięcie argininy poprzez zwiększoną aktywność ARG-1 jest bardzo skuteczną immunosupresyjną strategią nowotworu, mającą na celu zablokowanie działania jednego z filarów odpowiedzi przeciwnowotworowej – cytotoksycznych limfocytów T. Z tego względu, ARG-1 wydaje się być doskonałym celem terapeutycznym do walki z nowotworem. ARG-1 jest wytwarzana przez różne komórki obecne w mikrośrodowisku guza: fibroblasty, MDSC, komórki nowotworowe, jak m.in.: raka nerki, piersi, gruczołu krokowego, okrężnicy i wiele innych. Blokowanie aktywności enzymatycznej ARG-1 za pomocą drobnocząsteczkowych inhibitorów wykazało niewielkie, ale zauważalne działanie przeciwnowotworowe. Duże nadzieje na bardziej skuteczne leczenie przeciwnowotworowe wiązane są z terapiami łączącymi inhibitory ARG-1 z innymi lekami ingerującymi w immunosupresyjne środowisko guza, np. z inhibitorami punktów kontrolnych.
Innym enzymem związanym z metabolizmem aminokwasów i obecnym w mikrośrodowisku guza jest 2,3-dioksygenaza indolowa (IDO). IDO odpowiada za rozkład egzogennego aminokwasu – tryptofanu. Badania wykazały, że wiele nowotworów, m.in. czerniak, glejak, rak piersi wytwarza duże ilości IDO. Nowotwory te wykazują zwiększoną zdolność do ucieczki spod kontroli układu odpornościowego. Obniżenie ilości tryptofanu w mikrośrodowisku guza jest zatem kolejnym ważnym czynnikiem indukującym immunosupresję. Co więcej, badania przedkliniczne (prowadzone na zwierzętach) wykazały, że zablokowanie aktywności enzymatycznej IDO, poprzez zastosowanie drobnocząsteczkowych inhibitorów, prowadzi do zwiększenia przeciwnowotworowej odpowiedzi immunologicznej. Skuteczność przeciwnowotworowa tych inhibitorów testowana jest obecnie w badaniach klinicznych, głównie w połączeniu z innymi lekami. Wpływ enzymów degradujących argininę i tryptofan na rozwój przeciwnowotworowej odpowiedzi immunologicznej zilustrowano poniżej:
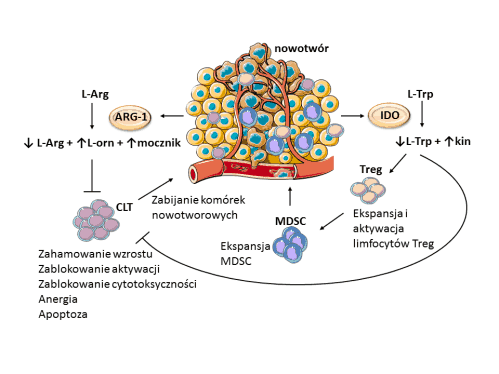
Ryc 2. Rola enzymów degradujących argininę (L-Arg) i tryptofan (L-Trp) w generowaniu supresyjnego mikrośrodowiska w guzie. Skróty: ARG-1: arginaza-1; CLT: cytotoksyczne limfocyty T; IDO: 2,3-dioksygenaza indolowa; kin: kinurenina; L-Arg: L-arginina; L-orn: L-ornityna; L-Trp: L-tryptofan; MDSC: mieloidalne komórki supresorowe; Treg: limfocyty regulatorowe.
WNIOSKI I DALSZE KIERUNKI ROZWOJU
Podsumowując, badania prowadzone w ostatnich latach wykazały złożoność mechanizmów immunosupresyjnych w mikrośrodowisku guza. Naukowcy są zgodni, że lepsze zrozumienie tych mechanizmów przyczyni się do opracowania nowych, bardziej skutecznych metod immunoterapii nowotworów. Bardzo istotne będzie również zrozumienie mechanizmów oporności na nowe leki blokujące immunosupresyjne środowisko guza, w szczególności na inhibitory ARG-1 i IDO. Umożliwi to projektowanie nowoczesnego leczenia celującego w mechanizmy adaptacyjne indukowane w komórkach nowotworowych lub ich otoczeniu. Z całą pewnością można powiedzieć, że nadszedł właśnie czas, w którym immunoterapia zaczyna odgrywać kluczowa rolę jako jedna z bardziej skutecznych i nowatorskich metod leczenia nowotworów. Dalsze badania, a w szczególności badania mikrośrodowiska guza, mogą jedynie wzmocnić już rosnącą rolę immunoterapii w leczeniu nowotworów.

Autorzy: lek. med. Andreas V. Hadjinicolaou, prof. dr hab. Dominika Nowis, dr Małgorzata Firczuk, dr Tomasz Rygiel.
źródło: www.stream.wum.edu.pl