Adoptywny transfer komórek jest rodzajem immunoterapii nowotworów, która wykorzystuje pobrane od pacjentów komórki cytotoksyczne (limfocyty T lub komórki NK). Komórki te poddawane są aktywacji i modyfikacjom in vitro (w warunkach laboratoryjnych), mającym na celu nasilenie rozpoznawania i zabijania komórek nowotworowych. Niedawno zastosowana modyfikacja tej techniki, wykorzystująca chimeryczne receptory antygenowe (ang. chimeric antygen receptors – CARs), okazała się skuteczną metodą leczenia pacjentów z zaawansowanymi nowotworami układu krwiotwórczego.
Czym jest cząsteczka CAR?
CAR to inaczej chimeryczny receptor antygenowy (ang. chimeric antygen receptor). Jest to cząsteczka zbudowana z domen wiążących antygen, pochodzących z przeciwciała, oraz z domeny aktywującej, pochodzącej z kompleksu receptora limfocytu T (Ryc.1). W nowszych generacjach receptorów CAR występują dodatkowo cząsteczki ko-stymulujące.
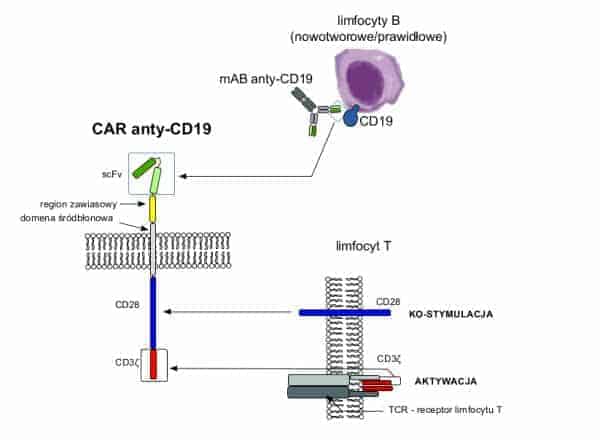
Ryc.1 Schemat przedstawiający receptor CAR
Pierwsze doniesienie opisujące konstrukcję funkcjonalnego receptora CAR zostało opublikowane w 1989 przez Zeliga Eshhara. CAR I generacji był białkiem fuzyjnym składającym się z fragmentu przeciwciała rozpoznającego 2,4,6-trinitrofenol (TNF) oraz łańcucha CD3ɀ, pochodzącego z kompleksu receptora limfocytu T. Zmodyfikowane limfocyty T, wykazujące ekspresję takiego receptora CAR, zdolne były do rozpoznania i zabicia komórek docelowych opłaszczonych TNF. Odkrycie to zapoczątkowało intensywne badania nad poszukiwaniem białek powierzchniowych na komórkach nowotworowych, które mogłyby być rozpoznawane przez receptory CAR. Ponadto, badania nad konstrukcją receptorów CAR doprowadziły do wniosku, że sam fragment łańcucha CD3ɀ nie zawsze jest wystarczający dla pełnej aktywacji limfocytów T i że niezbędne są dodatkowe domeny ko-stymulujące.
Do jakich komórek wprowadza się receptory CAR? Dlaczego?
Receptory CAR wprowadza się do limfocytów T, należących do odpowiedzi immunologicznej swoistej, oraz komórek NK, będących elementem odporności nieswoistej. Komórki te mają naturalny potencjał cytotoksyczny, co oznacza, że zdolne są do zabijania komórek zakażonych wirusem lub komórek nowotworowych. Niestety, komórki nowotworowe rozwijają szereg mechanizmów ucieczki przed nadzorem komórek cytotoksycznych i tym sposobem stają się dla nich „niewidzialne”. Jeśli porównamy limfocyty T i komórki NK do uzbrojonych łowców nagród, to zmodyfikowanie ich cząsteczkami CAR jest jak podarowanie im bardzo dokładnego narzędzia służącego do namierzania „złych komórek” oraz licencji na ich zabijanie.
Jak wprowadza się cząsteczki CAR do komórek?
W pierwszej kolejności limfocyty T lub komórki NK izolowane są z krwi pacjenta w procesie nazywanym leukaferezą. Następnie, w warunkach laboratoryjnych w hodowli in vitro, komórki te zostają poddane modyfikacjom genetycznym, mającym na celu uzyskanie ekspresji cząsteczek CAR na ich powierzchni. Istnieje kilka metod modyfikacji tych komórek. Jedną z metod jest elektroporacja mRNA kodującego receptor CAR, która prowadzi do krótkotrwałej (2-3 dni) ekspresji receptora na powierzchni limfocytów. mRNA wprowadzane jest do komórek za pomocą impulsu/szoku elektrycznego, gdzie następnie podlega translacji, fałdowaniu oraz zakotwiczeniu w błonie komórkowej. Inną metodą, umożliwiającą długotrwałą ekspresję receptorów CAR, jest modyfikacja przy użyciu wektorów retro- lub lentiwirusowych. Komórki T lub NK zostają zainfekowane cząsteczkami wirusa zawierającymi gen kodujący receptor CAR, który zostaje wbudowany do genomu komórki docelowej. Ta metoda umożliwia stabilną ekspresję receptorów CAR. W końcowym etapie, zmodyfikowane komórki T lub NK są namnażane, aktywowane i w końcu wstrzykiwane z powrotem do krwiobiegu pacjenta.
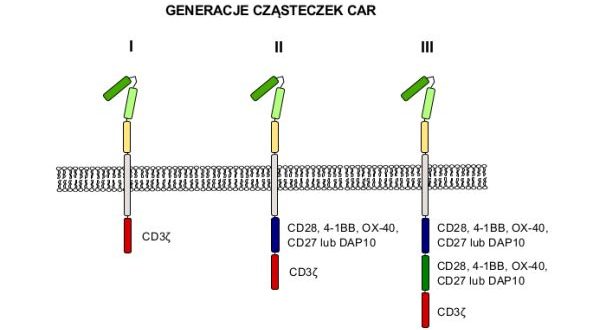
Generacje receptorów CAR
Nowoczesne cząsteczki CAR, wykorzystywane obecnie w badaniach klinicznych, mają bardziej złożoną budowę w porównaniu do cząsteczki CAR I generacji. Receptory CAR kolejnych generacji zbudowane są z zewnątrzkomórkowej domeny rozpoznającej antygen nowotworowy, która połączona jest regionem zawiasowym i domeną śródbłonową z kilkoma domenami wewnątrzkomórkowymi. Domeną rozpoznającą antygen nowotworowy jest zazwyczaj jednołańcuchowy fragment zmienny przeciwciała (ang. single-chain variable fragment – scFv). Region zawiasowy, który w istotny sposób wpływa na elastyczność konstruktu i jego zdolność do wiązania się z antygenem, najczęściej pochodzi z przeciwciała klasy IgG1. Wewnątrzkomórkowe domeny przekazujące sygnał pochodzą od cząsteczek sygnałowych obecnych na limfocytach T. Liczba domen ko-stymulujących receptora CAR determinuje jego przynależność do kolejnej generacji. Jak wspomniano, w cząsteczkach CAR I generacji przekazywanie sygnału odbywa się jedynie poprzez fragment łańcucha CD3ɀ. W II generacji, oprócz łańcucha CD3ɀ znajduje się dodatkowa domena ko-stymulująca, taka jak CD28, OX40, 4-1BB, CD27 lub DAP10. III generacja receptorów CAR zbudowana jest, oprócz łańcucha CD3ɀ, z dwóch w/w domen w różnych kombinacjach. Schemat budowy kolejnych generacji receptorów CAR przedstawiono na poniższej grafice.
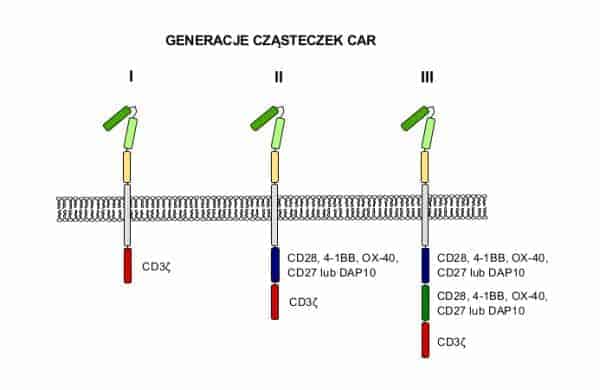
Ryc.2 Schemat przedstawiający kolejne generacje receptorów CAR
Zalety i ograniczenia receptorów CAR
Największą zaletą receptorów CAR jest unikatowy mechanizm rozpoznawania antygenów na komórkach nowotworowych. W przeciwieństwie do fizjologicznego receptora limfocytów T, który rozpoznaje antygen peptydowy w kompleksie z białkiem MHC („zaprezentowany” przez cząsteczki MHC), CAR bezpośrednio wiąże antygeny nowotworowe w sposób niezależny zarówno od powierzchniowej ekspresji białka MHC, jak i proteosomalnej obróbki prezentowanych białek. Jest to niezwykle istotne, gdyż komórki nowotworowe mają często obniżony poziom ekspresji MHC lub białek związanych z proteosomalną obróbką antygenów.
Należy jednak podkreślić, że największa zaleta jest jednocześnie ograniczeniem skuteczności receptorów CAR. O ile peptydy rozpoznawane przez receptor limfocytów T mogą pochodzić od cząsteczek wewnątrzkomórkowych, o tyle celem komórek zmodyfikowanych receptorem CAR mogą być jedynie cząsteczki znajdujące się na powierzchni komórek nowotworowych. Zmniejsza to liczbę potencjalnych cząsteczek docelowych rozpoznawanych przez cząsteczki CAR.
Antygeny nowotworowe rozpoznawane przez receptory CAR
Najbardziej spektakularne sukcesy immunoterapii z udziałem limfocytów CAR uzyskano w dziedzinie hemato-onkologii. Jak dotąd, najlepiej przebadanym celem terapii wykorzystującej receptor CAR jest cząsteczka CD19, obecna na limfocytach B i nowotworach wywodzących się z tych komórek, takich jak chłoniaki i białaczki, a której nie ma na powierzchni żadnej innej tkanki. W badaniach klinicznych testujących skuteczność CAR anty-CD19 u pacjentów z zaawansowaną ostrą białaczką limfoblastyczną wywodzącą się z komórek B (ang. B cell acute lymhoblastic leukemia – B-ALL) uzyskano spektakularny współczynnik całkowitej remisji choroby, pomiędzy 66 a 90%! W leczeniu zaawansowanej, opornej na chemioterapię przewlekłej białaczki limfocytowej (ang. chronic lymphocytic leukemia – CLL) terapia za pomocą CAR anty-CD19 spowodowała całkowitą (25% pacjentów) lub częściową (25% pacjentów) remisję choroby. W badaniach klinicznych w hemato-onkologii testowane są również receptory CAR rozpoznające inne białka powierzchniowe limfocytów B, np. CD20. Zastosowanie CAR anty-CD20 w leczeniu chłoniaków rozlanych z dużych komórek B (ang. diffuse large B-cell lymphoma – DLBCL) spowodowało całkowitą (16% pacjentów) lub częściową (50% pacjentów) remisję, zaś u 16% pacjentów stabilizację choroby.
Prowadzone są również próby wykorzystania limfocytów zmodyfikowanych receptorami CAR w leczeniu guzów litych. Najwięcej badań dotyczy wykorzystania antygenu HER2 (ang. human epidermal growth factor receptor 2), obecnego przykładowo na powierzchni niektórych mięsaków (sarcoma). Niestety, jak do tej pory wyniki badań klinicznych wykorzystujących CAR anty-HER2 są mniej optymistyczne niż w wypadku nowotworów hematologicznych. Choć większość badań klinicznych testujących skuteczność CAR anty-HER2 zakończyło się pomyślnie, indukując stabilizację choroby, w jednym przypadku wystąpiło poważne powikłanie, które zakończyło się zgonem pacjenta. Powikłanie to spowodowane było rozpoznaniem przez CAR antygenu HER2 obecnego w nabłonku płuc, co doprowadziło do poważnych uszkodzeń i zahamowania czynności oddechowych. W wyżej wymienionych badaniach wykorzystywano różne konstrukty CAR anty-HER2, co może tłumaczyć rozbieżności w uzyskanych wynikach i podkreśla istotną rolę odpowiedniej konstrukcji cząsteczek CAR.
Pozostałe wyzwania
Ostatni przykład dobitnie pokazuje, że określenie efektywności i bezpieczeństwa domen używanych do konstrukcji receptorów CAR, wciąż pozostaje ogromnym wyzwaniem. Ponadto, istnieje wiele innych trudności związanych z zastosowaniem receptorów CAR w terapii nowotworów, takich jak wybór odpowiednich antygenów nowotworowych, czy immunosupresyjne mikrośrodowisko nowotworu, hamujące działanie limfocytów zmodyfikowanych receptorami CAR. W wypadku guzów litych dodatkowym ograniczeniem jest mało efektywna infiltracja guzów przez zmodyfikowane komórki cytotoksyczne. Optymalizacji wymagają również metody modyfikacji komórek cytotoksycznych oraz sposobu przekazywania sygnału w komórkach cytotoksycznych. Pomimo powyższych trudności, nieograniczone możliwości modyfikacji cząsteczek CAR, jak i możliwość ich zastosowania w połączeniu z innymi lekami, w szczególności z inhibitorami punktów kontroli odpowiedzi immunologicznej, tworzą obiecujące perspektywy szerszego wykorzystania receptorów CAR w terapii nowotworów.
 CARs – chimeryczne receptory antygenowe
CARs – chimeryczne receptory antygenowe
Autorzy: Agnieszka Graczyk-Jarzynka, Małgorzata Firczuk, Radosław Zagożdżon
źródło: www.stream.wum.edu.pl
 CARs – chimeryczne receptory antygenowe
CARs – chimeryczne receptory antygenowe