Leczenie chorych na niedrobnokomórkowego raka płuca nie pozwala na kontrolę choroby u wszystkich pacjentów. Dlatego tak ważne staje się zbadanie skojarzenia przeciwciał anty-PD1 i anty-PD-L1 z innymi lekami i metodami terapii. W zamieszczonym fragmencie artykułu Autorzy omawiają immunoterapię w skojarzeniu z chemioterapią.
Źródło: dr hab. n. med. Kamila Wojas-Krawczyk, prof. dr hab. n. med. Paweł Krawczyk „Przeciwciała anty-PD-1 i anty-PD-L1 w skojarzeniu z innymi metodami leczenia – czy to przyszłość terapii zaawansowanego NDRP?” w Immunoterapia nr 1/2019
Sukces immunoterapii ukierunkowanej na zablokowanie immunologicznych punktów kontroli zmienił spojrzenie na leczenie niedrobnokomórkowego raka płuca (NDRP). W chwili obecnej do leczenia NDRP zarejestrowane są w Unii Europejskiej cztery immunoterapeutyki, które blokują kluczowy szlak hamowania aktywności limfocytów T. Są to:
- przeciwciała monoklonalne anty-PD-1 (niwolumab i pembrolizumab), blokujące cząsteczkę PD-1 obecną na powierzchni limfocytów T,
- przeciwciała anty-PD-L1 (atezolizumab i durwalumab), blokujące cząsteczkę PD-L1 znajdującą się na powierzchni komórek nowotworowych i na powierzchni komórek układu immunologicznego naciekających tkankę nowotworową.
Interakcja cząsteczek PD-1 (ang. programmed death 1) i PD-L1 (ang. programmed death ligand 1) doprowadza do wygaszenia aktywności przeciwnowotworowej limfocytów T. Idea immunoterapii z wykorzystaniem przeciwciał przeciwko immunologicznym punktom kontroli opiera się na zablokowaniu jednej z tych cząsteczek, co przywraca aktywność cytotoksyczną limfocytów T.
Wiele badań klinicznych, a w szczególności badania CheckMate-017, CheckMate-057, Keynote-010 i OAK, wykazało skuteczność przeciwciał anty-PD-1 i anty-PD-L1 w leczeniu 2. i kolejnych linii chorych na zaawansowanego niedrobnokomórkowego raka płuca w porównaniu do chemioterapii. Co więcej, bardzo zachęcające wyniki badania Keynote-024 (odsetek obiektywnych odpowiedzi u pacjentów otrzymujących immunoterapię wyniósł 44,8%, a u chorych otrzymujących chemioterapię 1. linii – 27,8%, immunoterapia znamiennie wydłużyła czas przeżycia wolnego od progresji i przeżycia całkowitego) umożliwiły wprowadzenie pembrolizumabu do 1. linii leczenia chorych na NDRP, u których odsetek komórek nowotworowych z ekspresją cząsteczki PD-L1 był równy lub większy niż 50%.
Czy istnieje potrzeba łączenia immunoterapii z innymi strategiami terapeutycznymi?
Niestety immunoterapia nie jest metodą leczenia, z której korzyść odniosą wszyscy lub prawie wszyscy chorzy na NDRP, jak w przypadku terapii ukierunkowanych molekularnie stosowanych w ściśle wybranych grupach pacjentów. Wynika to z braku czynnika predykcyjnego, który jednoznacznie pozwalałby zakwalifikować pacjentów do immunoterapii.
Występowanie ekspresji PD-L1 na komórkach nowotworowych jest jak dotąd jedynym czynnikiem predykcyjnym, który wykorzystano w kwalifikacji chorych na NDRP do monoterapii pembrolizumabem. Wykazano jednak, że odpowiedź na leczenie możliwa jest także u pacjentów bez ekspresji tej cząsteczki i zależy np. od obciążenia komórek nowotworowych mutacjami somatycznymi (ang. tumor mutationburden – TMB) lub immunofenotypu guza. Jednak te czynniki predykcyjne nie zostały dotychczas zbadane w sposób satysfakcjonujący. Dlatego, w celu wykazania możliwości odniesienia korzyści z immunoterapii u chorych z różnym statusem PD-L1 czy TMB, przeprowadzono szereg badań klinicznych, w których klasyczną immunoterapię łączono z innymi metodami leczenia raka płuca.
Synergistyczne działanie różnych opcji terapeutycznych może zwiększyć skuteczność immunoterapii ukierunkowanej na zablokowanie immunologicznych punktów kontroli. Wydaje się, że celem terapii skojarzonej jest wytworzenie sprzyjającego środowiska i zmaksymalizowanie potencjału układu immunologicznego do skuteczniejszej obrony przeciwnowotworowej.
Immunoterapia w skojarzeniu z chemioterapią
Chemioterapia 1. linii oparta na związkach platyny jest najstarszą metodą leczenia systemowego u chorych na miejscowo zaawansowanego i zaawansowanego NDRP, u których niemożliwe jest zastosowanie radioterapii.
Schematy leczenia łączące cisplatynę lub karboplatynę z cytostatykami kolejnych generacji (winorelbiną, gemcytabiną,paklitakselem, docetakselem lub pemetreksedem) umożliwiły uzyskanie odpowiedzi na leczenie u 35–40% chorych oraz osiągnięcie mediany czasu wolnego od progresji (ang. progression free survival – PFS) wynoszącej 6–8 miesięcy. Czas życia pacjentów otrzymujących chemioterapię zazwyczaj nie przekraczał jednego roku.
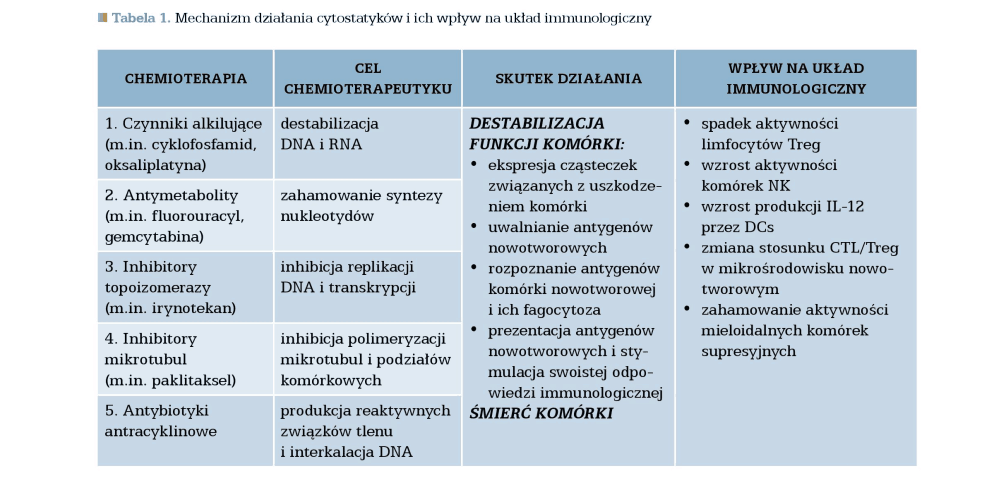
Pomimo różnych mechanizmów działania poszczególnych cytostatyków (związki platyny – bezpośrednie uszkodzenie DNA poprzez alkilację, gemcytabina – wbudowywanie fałszywego nukleotydu do DNA, winorelbina i taksoidy – wiązanie z tubulinami wrzeciona podziałowego, pemetreksed – upośledzenie syntezy nukleotydów) nie wykazano istotnych różnic w długości życia chorych stosujących różne schematy chemioterapii. Wymienione cytostatyki mogą jednak w różnym mechanizmie zwiększać immunogenność nowotworu, co dostarczyło przesłanek do przeprowadzenia prób klinicznych wykorzystujących kojarzenie chemioterapii i immunoterapii w 1. linii leczenia u chorych na NDRP.
Mechanizm działania cytostatyków i ich wpływ na układ immunologiczny został przedstawiony w poniżej tabeli:
Badania Keynote-189 i Keynote-407
Najbardziej spektakularnych dowodów na efektywność takiej metody leczenia dostarczyły badania Keynote-189 i Keynote-407.
W pierwszym z nich skuteczność pembrolizumabu w połączeniu z chemioterapią za pomocą związków platyny i pemetreksedu porównywano do skuteczności samej chemioterapii u chorych na zaawansowanego NDRP o typie innym niż płaskonabłonkowy. Dodanie pembrolizumabu do chemioterapii obniżyło ryzyko zgonu w porównaniu do samej chemioterapii o 51% (HR = 0,49; 95% CI: 0,38–0,64). Mediana przeżycia całkowitego (ang. overall survival – OS) nie została osiągnięta u osób leczonych kombinacją immuno- i chemioterapii i wyniosła 11,9 miesiąca u pacjentów otrzymujących chemioterapię (w momencie publikacji wyników 33,8% chorych było wciąż leczonych pembrolizumabem w połączeniu z chemioterapią). Roczne przeżycia zanotowano u 69% chorych leczonych terapią skojarzoną i u 49% otrzymujących tylko chemioterapię. Wydłużeniu uległa także mediana PFS u osób leczonych pembrolizumabem w porównaniu do chorych nieotrzymujących tego leku (8,8 vs. 4,9 miesiąca). Nie stwierdzono istotnego wzrostu częstości występowania poważnych (w stopniu 3. i wyższym) działań niepożądanych immunoterapii w skojarzeniu z chemioterapią w porównaniu do samej chemioterapii (67,2 vs. 65,8%). Co najważniejsze, korzyść ze stosowania terapii skojarzonej obserwowano we wszystkich grupach chorych o różnym statusie ekspresji PD-L1 na komórkach nowotworowych. Wprawdzie częstość odpowiedzi na leczenie, mediana PFS oraz odsetek pacjentów żyjących rok były wyższe u osób z ekspresją PD-L1 na ≥ 50% komórek nowotworowych (61,4%, 9,4 miesiąca oraz 73%) niż u chorych bez ekspresji tej cząsteczki (32,3%, 6,1 miesiąca oraz 61,7%), ale w obu tych grupach immunoterapia w skojarzeniu z chemioterapią wykazywała istotnie wyższą skuteczność w zakresie omawianych parametrów niż sama chemioterapia.
Podobne wyniki uzyskano w badaniu Keynote-407, w którym pembrolizumab łączono z chemioterapią z udziałem cisplatyny i paklitakselu lub nab-paklitakselu u chorych na zaawansowanego płaskonabłonkowego raka płuca. Redukcja ryzyka zgonu na korzyść terapii skojarzonej w porównaniu do samej chemioterapii wyniosła w tym przypadku 36% (HR = 0,64; 95% CI: 0,49–0,85), przy czym mediana OS u pacjentów otrzymujących immunoterapię i chemioterapię osiągnęła 15,9 miesiąca, a u chorych otrzymujących tylko chemioterapię – 11,3 miesiąca. Mediana PFS była także dłuższa u osób leczonych pembrolizumabem i chemioterapią niż u chorych leczonych tylko chemioterapią (6,4 vs. 4,8 miesiąca). W badaniu tym wykazano brak wpływu ekspresji PD-L1 na skuteczność kombinacji pembrolizumabu i chemioterapii. U chorych bez ekspresji PD-L1 redukcja ryzyka zgonu na korzyść terapii skojarzonej w porównaniu do samej chemioterapii wyniosła 39% (HR = 0,61; 95% CI: 0,38–0,98), a u pacjentów z ekspresją PD-L1 na ≥ 50% komórek nowotworowych – 36% (HR = 0,64; 95% CI: 0,37–1,10). Profil toksyczności immunoterapii z chemioterapią nie był istotnie gorszy niż samej chemioterapii.
Wyniki obu omówionych badań umożliwiły w 2018 roku rejestrację terapii skojarzonej z udziałem pembrolizumabu w UE i w USA.
Badanie IMpower150
W niektórych krajach standardem leczenia 1. linii wybranych chorych na NDRP o typie innym niż płaskonabłonkowy jest kojarzenie chemioterapii i bewacyzumabu. Bewacyzumab jest przeciwciałem anty-VEGF (ang. vascular endothelial growth factor) o działaniu antyangiogennym. Przeciwnowotworowe działanie bewacyzumabu polega na upośledzeniu wzrostu naczyń w obrębie guza i spowolnieniu proliferacji komórek nowotworowych. Ponadto naczynia krwionośne w wyniku stosowania bewacyzumabu przebiegają w guzie w sposób bardziej uporządkowany, a ich ściana staje się bardziej szczelna, co spowalnia powstawanie przerzutów odległych.
W badaniu IMpower150 badano skuteczność trzech metod leczenia:
- atezolizumabu w połączeniu z chemioterapią,
- bewacyzumabu w połączeniu z chemioterapią
- atezolizumabu w połączeniu z bewacyzumabem i chemioterapią.
W chemioterapii stosowano karboplatynę i paklitaksel.
Dane dotyczące skuteczności atezolizumabu w połączeniu z chemioterapią nie zostały dotąd (luty 2019 roku) opublikowane.
Porównano natomiast efektywność atezolizumabu w połączeniu z bewacyzumabem, karboplatyną (ang. carboplatin) i paklitakselem (schemat ABCP) oraz bewacyzumabu w połączeniu z karboplatyną i paklitakselem (schemat BCP).
Odpowiedź na leczenie wystąpiła u 63,5% chorych leczonych schematem ABCP i 48% leczonych schematem BCP, jeśli w komórkach nowotworowych nie stwierdzano mutacji w genie EGFR lub rearanżacji genu ALK. U osób bez tych nieprawidłowości genetycznych mediany PFS i OS były istotnie większe u pacjentów otrzymujących schemat ABCP (8,3 i 19,2 miesiąca) niż u chorych leczonych schematem BCP (6,8 i 14,8 miesiąca). Redukcja ryzyka zgonu na korzyść stosowania schematu ABCP w porównaniu ze schematem BCP wyniosła 28% (HR = 0,72; 95% CI: 0,64–0,96). Korzyść ze stosowania schematu ABCP w porównaniu ze schematem BCP utrzymywała się we wszystkich grupach chorych niezależnie od ekspresji PD-L1 na komórkach nowotworowych i immunologicznych oraz ekspresji genów kodujących białka związane z aktywnością limfocytów T (ang. effector T-cell gene signature). Zaznaczyć jednak należy, że redukcja ryzyka progresji była najwyższa w grupie chorych z ekspresją PD-L1 na ≥ 50% komórek nowotworowych lub na ≥ 10% komórek immunologicznych (HR = 0,39; 95% CI:0,25–0,60), a najmniejsza w przypadku braku ekspresji PD-L1 na tych komórkach (HR = 0,77;95% CI: 0,61–0,99).
Zaskakujący jest fakt, że chorzy z mutacjami w genie EGFR lub rearanżacją genu ALK w wyniku leczenia schematem ABCP mieli niemal identyczną redukcję ryzyka progresji (HR = 0,59; 95% CI: 0,37–0,94) jak osoby bez tych nieprawidłowości genetycznych (HR= 0,62; 95% CI: 0,52–0,74). Niespodziewanie terapia schematem ABCP była dość dobrze tolerowana przez pacjentów. Poważne działania niepożądane (w stopniu 3. lub 4.) wystąpiły u 55,7% osób otrzymujących schemat ABCP i u 47,7% leczonych schematem BCP. W obu grupach wystąpiły jednak zgony spowodowane leczeniem (2,8 i 2,3% chorych).
Wyniki badania IMpower150 pozwoliły na rejestrację w USA schematu zawierającego atezolizumab, bewacyzumab, karboplatynę i paklitaksel do leczenia 1. linii chorych na zaawansowanego NDRP o typie innym niż płaskonabłonkowy.
Pełna treść artykułu, w którym przedstawiono również informacje nt.: immunoterapii w skojarzeniu
z inhibitorami kinazy tyrozynowej EGFR oraz skojarzenie różnych metod immunoterapii (skojarzenie inhibitorów PD-1 lub PD-L1 i CTLA-4) dostępna w nr 1/2019 czasopisma „Immunoterapia”.