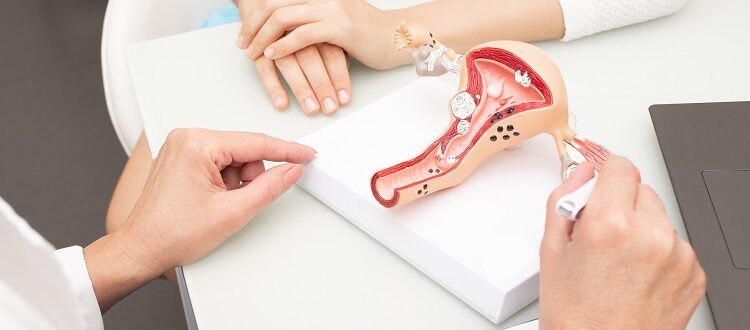
13 października 2021 roku Amerykańska Agencja ds. Żywności i Leków (FDA) zatwierdziła pembrolizumab w skojarzeniu z chemioterapią oraz w połączeniu z bewacyzumabem lub bez, jako leczenie pierwszej linii dla pacjentek z przetrwałym, nawrotowym lub przerzutowym rakiem szyjki macicy, wykazującym ekspresję PD-L1.
Zgoda FDA na stosowanie powyższej terapii została podjęta na podstawie danych pochodzących z badania klinicznego KEYNOTE-826 (NCT03635567).
W jego ramach analizie poddano skuteczność i bezpieczeństwo pembrolizumabu z paklitakselem i cisplatyną lub paklitakselem i karboplatyną, z bewacyzumabem lub bez. Do badania włączono łącznie 617 pacjentek z przetrwałym, nawrotowym lub przerzutowym rakiem szyjki macicy pierwszego rzutu, niezależnie od statusu ekspresji PD-L1.
Rak szyjki macicy – immunoterapia
Jak pisaliśmy już wcześniej, 12 czerwca 2018 roku Amerykańska Agencja ds. Żywności i Leków (FDA) zatwierdziła monoterapię cząsteczką pembrolizumab w leczeniu pacjentów z zaawansowanym, opornym na leczenie rakiem szyjki macicy wykazującym ekspresję PD-L1. Była to pierwsza tego typu immunoterapia dopuszczona w leczeniu zaawansowanego raka szyjki macicy.
Decyzja FDA z 2018 roku została oparta na wynikach z fazy II badania KEYNOTE-158. W ramach tej próby 98 pacjentów z zaawansowanym rakiem szyjki macicy otrzymało pembrolizumab. Wśród 77 pacjentów z nowotworami dodatnimi pod względem ekspresji PD-L1 na immunoterapię odpowiedziało 14,3%, a 91% tych odpowiedzi trwało sześć miesięcy lub dłużej.
Pembrolizumab w raku szyjki macicy
Pembrolizumab jest przeciwciałem, które wiąże się z receptorem programowanej śmierci komórki 1 (PD-1) i blokuje jego interakcję z ligandami PD-L1 i PD-L2. Receptor PD-1 jest negatywnym regulatorem aktywności limfocytów T, w stosunku do którego wykazano, że jest zaangażowany w kontrolowanie odpowiedz i immunologicznej limfocytów T.
Cząsteczka wspomaga odpowiedź limfocytów T, w tym odpowiedź przeciwnowotworową, poprzez zahamowanie wiązania PD-1 z PD-L1 i PD-L2, które ulegają ekspresji na komórkach prezentujących antygen i mogą ulegać ekspresji na komórkach nowotworowych oraz innych komórkach w mikrośrodowisku guza.
PRZEJDŹ DO: STRONA GŁÓWNA
źródła:
https://www.fda.gov/
http://www.cancerresearch.org/