Personalizacja leczenia onkologicznego stanowi jedno z największych osiągnięć współczesnej onkologii. Dziedzina medycyny zajmująca się schorzeniami nowotworowymi coraz silniej zespala się z biologią molekularną i genomiką (zajmującą się funkcjami genów). Dzięki postępowi w nauce i powstaniu wyrafinowanych testów diagnostycznych, badacze zyskali możliwość analizy genomu nowotworu oraz mechanizmów, które doprowadziły do jego rozwoju. Rozwój tzw. onkologii precyzyjnej otworzył nowy rozdział w walce z rakiem.
Jeszcze do niedawna przy wyborze metody leczenia kierowano się przede wszystkim miejscem powstania nowotworu, jego typem histologicznym i stopniem zaawansowania. Współcześnie wiadomo już, że nie tylko lokalizacja guza, ale również obecność mutacji genowych decyduje, że zastosowanie konkretnego leku może być skuteczne. Kluczowe są w tym kontekście produkty genów, które uległy mutacjom i doprowadziły do niekontrolowanego wzrostu komórek nowotworowych.
Co ważne, okazuje się, że podobne zmiany i mutacje można znaleźć w komórkach nowotworowych występujących – na pozór – w różnych jednostkach chorobowych np. w raku płuca i raku piersi. To sugeruje, że w pewnych sytuacjach skuteczne może być zastosować tych samych leków w leczeniu pacjentów z nowotworami zlokalizowanymi w różnych narządach.
Zmiany genomowe – jak powstaje nowotwór
Nasze ciało zbudowane jest z miliardów komórek. W każdej z nich znajdują się struktury zawierające informację genetyczną zapisaną w DNA. Geny stanowią instrukcję prawidłowego funkcjonowania dla komórek. Podczas każdego podziału komórki, jej materiał genetyczny ulega powieleniu, tak że komórka potomna posiada identyczny zapis genów jak komórka wyjściowa.
Zdarza się, że w DNA mogą powstać błędy w zapisie – mutacje. Przyczynami mutacji (zmian genomowych) mogą być rakotwórcze czynniki środowiskowe. Dana osoba może także posiadać wrodzoną predyspozycję do wystąpienia nowotworu.
Zwykle nasz organizm doskonale radzi sobie z naprawą błędów. W pewnych sytuacjach naprawa nie jest jednak możliwa i dochodzi do niekontrolowanego wzrostu komórek zawierających zmiany genomowe. Zmienione komórki zaczynają dzielić się w niekontrolowany sposób. Stanowi to początek rozwoju choroby nowotworowej.
W zależności od etapu rozwoju nowotworu, lekarz może zalecić różne metody standardowych terapii (chirurgia, radioterapia, chemioterapia). W niektórych przypadkach rozważyć można zastosowanie terapii celowanej, która ma na celu leczenie skutków konkretnej mutacji DNA lub immunoterapii.
W planowaniu optymalnej dla danego pacjenta terapii, lekarz może wykorzystać badanie profilu genomowego nowotworu. Badanie genomu czyta instrukcję zawartą w komórkach nowotworowych, aby zidentyfikować mutacje, które doprowadziły do powstania choroby.
Badanie genomowe może być pomocne w wyborze odpowiedniej terapii celowanej lub immunoterapii, która najbardziej odpowiada profilowi genomowemu danego guza. Stanowi to fundament onkologii precyzyjnej.
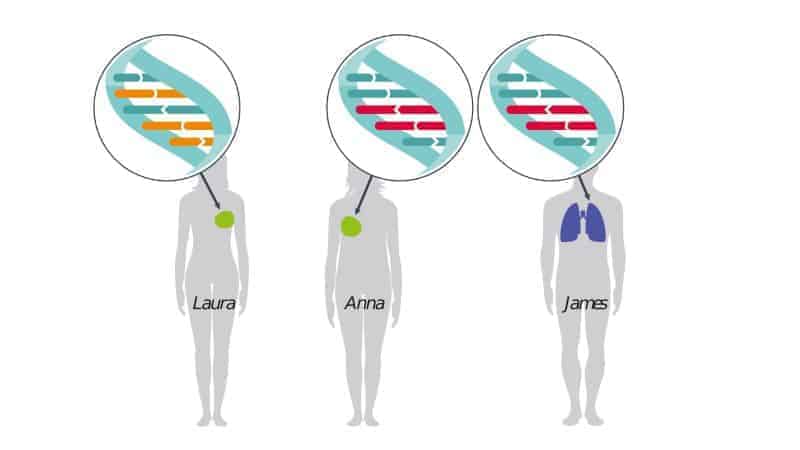
Grafika 1. Jeszcze do niedawna nowotwory były klasyfikowane przede wszystkim ze względu na miejsce występowania guza pierwotnego. Każdy pacjent, bez względu na typ nowotworu, leczony był na podstawie lokalizacji narządowej ogniska choroby. Dzięki postępowi w badaniach naukowych okazało się, że dwie osoby chorujące na ten sam typ nowotworu (np. raka piersi) mogą posiadać różne mutacje i wymagać zupełnie innego sposobu leczenia.
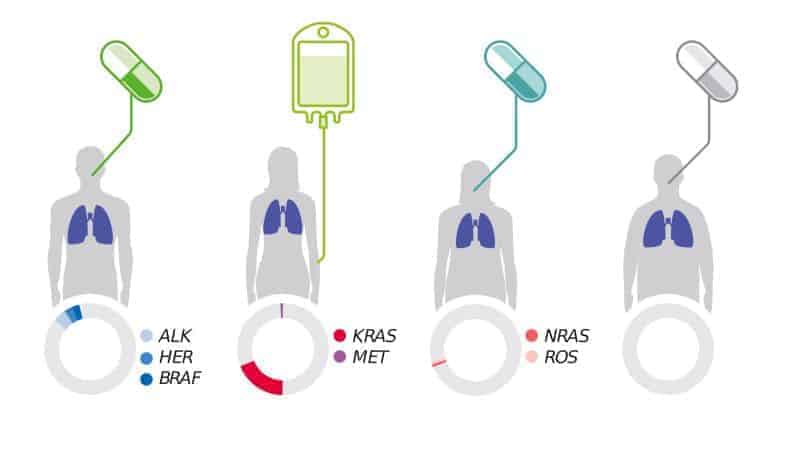
Grafika 2. Rodzaj i liczba występujących mutacji może być różna u indywidualnych pacjentów chorujących na dany typ nowotworu. Przykładem jest rak płuca, który uważany był za jedną chorobę. Obecnie wiemy, że istnieje wiele mutacji, które są zaangażowane w jego onkogenezę. Kompleksowe profilowanie genomowe (CGP) dostarcza informacji na temat nowotworu poprzez dokładną analizę wielu mutacji związanych z rozwojem choroby. Kompleksowe badanie zwiększa możliwości wykrycia istotnych mutacji oraz dedykowanych im spersonalizowanych terapii.
Onkologia precyzyjna – rewolucja w leczeniu nowotworów
Pojawienie się terapii ukierunkowanych na cele molekularne stanowiło przełom w leczeniu onkologicznym.
– Rozwój onkologii precyzyjnej stanowi zmianę paradygmatu w sposobie myślenia o leczeniu onkologicznym. Kluczowe nie jest umiejscowienie nowotworu, ale zaburzenia, które udało się zidentyfikować w badaniu molekularnym. Określenie uszkodzeń w genach umożliwia w wybranych przypadkach zastosowanie skutecznego leku. Dla przykładu, jeśli w raku płuca, raku jelita grubego, raku prostaty czy raku trzustki występują fuzje genu NTRK, to wiemy, że bez względu na to, że są to nowotwory występujące w różnych lokalizacjach, zareagują one na leki nakierowane na fuzję genu NTRK. Oczywiście nie oznacza to, że nie należy już stosować klasycznych metod leczenia. Onkologia precyzyjna stanowi pewną dodatkową furtkę, którą można otworzyć Pacjentowi – tłumaczy dr n. med. Marek Szwiec, Kierownik Oddziału Onkologii w Szpitalu Uniwersyteckim im. Karola Marcinkowskiego w Zielonej Górze, ekspert w obszarze genetyki nowotworów.
Kompleksowa diagnostyka molekularna pozwala określić profil genomowy danego nowotworu – wskazać jakie mutacje obecne są w jego DNA, jak wiele ich jest oraz czy występują mutacje wskazujące na oporność na pewne grupy leków. Na podstawie takiego całościowego obrazu lekarz może poszukać leków celowanych lub immunoterapii – pasujących do profilu molekularnego nowotworu danego pacjenta.
Zdarza się, że podobne zmiany i mutacje udaje się znaleźć w komórkach nowotworowych różnych jednostek chorobowych np. raka płuca i raka piersi. W takiej sytuacji w walce z nowotworami powstałymi w różnych narządach skuteczny będzie ten sam lek, działający na ten sam cel molekularny.
– Zaobserwowano, że pewne zmiany i zaburzenia molekularne w genach powtarzają się w różnych nowotworach, choć z odmienną częstotliwością. Mogą występować np. w raku piersi na poziomie 30 proc., a w raku płuca na poziomie 2 proc. Dlatego powstały badania kliniczne określane jako badania koszykowe. Oznacza to, że pacjenci są do nich włączani pod kątem znalezienia określonej zmiany molekularnej – bez względu na typ i lokalizację narządową rozpoznanego nowotworu. Od diagnostyki molekularnej nie ma już odwrotu. Warto ją postrzegać jako część pewnej większej układanki lepszego leczenia onkologicznego. Jej upowszechnienie pomoże znaleźć bardzo skuteczne terapie dla pewnych podgrup pacjentów – podsumowuje dr n. med. Marek Szwiec.
Foundation Medicine – w poszukiwaniu linii papilarnych raka
Zdaniem ekspertów, onkologia wkracza obecnie w przełomowy etap wszechstronnego profilowania genomowego. Rozwój wiedzy, który umożliwił dokładniejsze badanie nowotworów i bardziej precyzyjne leczenie chorych, wynika w dużej mierze z postępów w dziedzinie biologii molekularnej i sekwencjonowania DNA. Naukowcy zyskali możliwość wiarygodnego i powtarzalnego opisywania genomu nowotworów.
Wiedza o diagnostyce molekularnej wzrasta lawinowo, ale czasem trudno za tym postępem nadążyć. Najnowsze testy molekularne nie są refundowane w Polsce i pozostają dostępne dla Pacjentów na zasadach komercyjnych.
Niektórzy chorzy decydują się na wysłanie fragmentu tkanki guza pobranego podczas biopsji za granicę. Jednym z liderów w obszarze kompleksowego profilowania genomowego nowotworów jest firma Foundation Medicine z Cambridge koło Bostonu.
W Foundation Medicine opracowano kompletną i zwalidowaną metodę pozwalającą na wskazanie zmian genomowych związanych z rozwojem danego nowotworu. Kompleksowe profilowanie genomowe polega na odczytaniu (sekwencjonowaniu) genów komórek nowotworowych.
W przypadku Foundation Medicine badanie wykorzystuje technikę NGS (Next-Generation Sequencing) z wykorzystaniem technologii hybrid capture. Umożliwia to szybkie zbadanie całej sekwencji kodującej DNA w danym genie. W jednym badaniu sekwencjonuje się setki genów odpowiedzialnych za powstawanie i rozwój nowotworów.
Badania kompleksowego profilowania genomowego nowotworów
Kompleksowe profilowanie genomowe wskazuje, które zmiany w genomie komórek spowodowały wystąpienie i rozwój nowotworu oraz czy istnieje leczenie ukierunkowane na te zmiany.
- Lekarz zleca badanie
- Tkanka nowotworowa lub krew zostaje wysłana do laboratorium
- Sekwencjonowanie DNA
- Analiza wyników – praca wielu ekspertów nad przygotowaniem raportu – wyniku z badania
- Raport firmy Foundation Medicine jest gotowy po około 14 dniach
Do wykrytych w badaniu genomowym mutacji można przypisać leki celowane – potencjalnie skuteczne u danego pacjenta. W wyniku kompleksowego profilowania genomowego można uzyskać również informację o poziomie niestabilności mikrosatelitarnej (MSI) i gęstości mutacji (TMB) – biomarkerach powiązanych z prawdopodobieństwem odpowiedzi Pacjenta na immunoterapię.
Niektóre z leków wskazanych w Raporcie z badania mogą być refundowane w leczeniu danej choroby lub pozostawać dostępne jedynie w ramach badań klinicznych.
– Wszechstronne profilowanie genomowe zmienia sposób myślenia i podejścia do leczenia nowotworów. Najprościej odnieść się do przykładu raka płuca. W badaniach molekularnych można zidentyfikować liczne mutacje odpowiedzialne za jego rozwój. Dzięki metodzie profilowania genomowego nowotworów stosowanej przez Foundation Medicine otrzymujemy pełną informację o zmianach genomowych w nowotworze indywidualnego pacjenta. Badanie może wykazać dodatkowe możliwości leczenia, różne dla poszczególnych chorych. Niestety czasem refundowanego jedynie w leczeniu nowotworów, zlokalizowanych w innym narządzie – wyjaśnia w materiale Polskiej Agencji Prasowej dr Aleksander Sowa, biolog molekularny, dyrektor ds. strategii i rozwoju portfolio w Roche Polska.
Zobacz więcej na http://www.foundationone.pl/