Ministerstwo Zdrowia opublikowało projekt nowej listy leków refundowanych, która zacznie obowiązywać od 1 maja 2021 roku. Do refundacji wejdzie nowa cząsteczka immunokompetentna awelumab w leczeniu pacjentów z przerzutowym rakiem z komórek Merkla (nowotwór skóry).
Awelumab to ludzkie przeciwciało monoklonalne IgG1 skierowane przeciwko immunomodulującemu ligandowi białka powierzchniowego PD-L1. Działanie awelumabu polega na wspomaganiu układu immunologicznego w walce z nowotworem.
Lek będzie refundowany w Polsce w ramach nowego programu lekowego B.117 Leczenie raka z komórek Merkla awelumabem (ICD-10 C44).
Awelumab w leczeniu raka z komórek Merkla
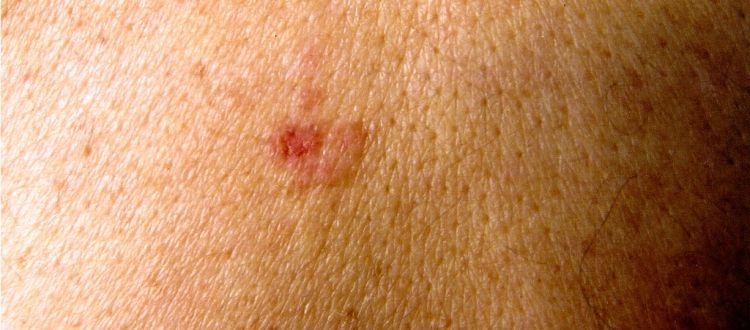
Rak z komórek Merkla (MCC) to neuroendokrynny nowotwór skóry o bardzo złośliwym przebiegu. Zachorowania są bardzo rzadkie i szacunkowo ocenia się je na poziomie 0,23 na 100 tysięcy białej populacji. Większość przypadków występuje w starszym wieku. Rak z komórek Merkla zazwyczaj zlokalizowany jest na obszarach skóry narażonych na ekspozycję słońca. Zwykle objawia się on jako czerwony guzek o gładkiej powierzchni z licznymi teleangiektazjami.
W połowie przypadków w momencie rozpoznania obecne są już przerzuty do węzłów chłonnych. W leczeniu raka z komórek Merkla stosuje się standardowo radykalną resekcję ogniska pierwotnego wraz z regionalnymi węzłami chłonnymi, radioterapię i chemioterapię.
Zastosowanie immunoterapii awelumabem stanowi nowe narzędzie w walce z rakiem z komórek Merkla.
FDA: rejestracja awelumabu na terenie USA
Dla przypomnienia, cząsteczka awelumab (inhibitor PD-L1) została dopuszczona w 2017 roku w trybie przyspieszonym przez Amerykańską Agencję ds. Żywności i Leków (FDA) w leczeniu dorosłych i dzieci (w wieku od 12 lat) z przerzutowym rakiem z komórek Merkla (Merkel cell carcinoma), włączając pacjentów, którzy nie otrzymywali wcześniejszej chemioterapii.
Decyzja została oparta na danych pochodzących z badania II fazy JAVELIN Merkel 200, które zostało zaprezentowane podczas spotkania ASCO 2016 oraz opublikowane w Lancet Oncology. W badaniu wzięło 88 chorych z potwierdzonym histologicznie rakiem z komórek Merkla, u których nastąpiła progresja w trakcie lub po zastosowanej chemioterapii.
Immunoterapia z wykorzystaniem cząsteczki awelumab poddawana jest obecnie licznym badaniom klinicznym, które obejmują różne podtypy nowotworów.
W styczniu 2021 roku Komisja Europejska zatwierdziła awelumab jako terapię podtrzymującą pierwszego rzutu u dorosłych pacjentów z miejscowo zaawansowanym lub przerzutowym rakiem urotelialnym (rak pęcherza moczowego). Więcej na ten temat TUTAJ.
PRZEJDŹ DO: NAJNOWSZE DONIESIENIA