Komórki NK należą do komórek układu odpornościowego i stanowią 5%-15% limfocytów. Zostały odkryte i opisane w latach 70-tych XX wieku i od tamtej pory są intensywnie badane ze względu na ich unikalne zdolności zabijania komórek nowotworowych lub komórek zakażonych wirusem. Zdolność do zabijania komórek docelowych, zwana inaczej cytotoksycznością komórek NK, podlega ścisłej regulacji i zależy od pobudzenia odpowiednich receptorów hamujących (tj. receptory typu KIR) i aktywujących, obecnych na komórkach NK.
Po rozpoznaniu komórki docelowej dochodzi do aktywacji komórki NK, jej polaryzacji w kierunku tworzącej się synapsy immunologicznej (połączenia miedzy komórką NK a komórką docelową), gdzie dochodzi do fuzji uwolnionych ziarnistości z błoną komórkową i uwolnienia cząsteczek cytotoksycznych (m.in. perforyny i granzymów) – proces ten znany jest jako degranulacja. Komórki NK, wytwarzając cytokiny, mogą także regulować i angażować inne komórki układu odpornościowego. Powyższe właściwości czynią komórki NK potężnym narzędziem o możliwych zastosowaniach w terapii komórkowej.
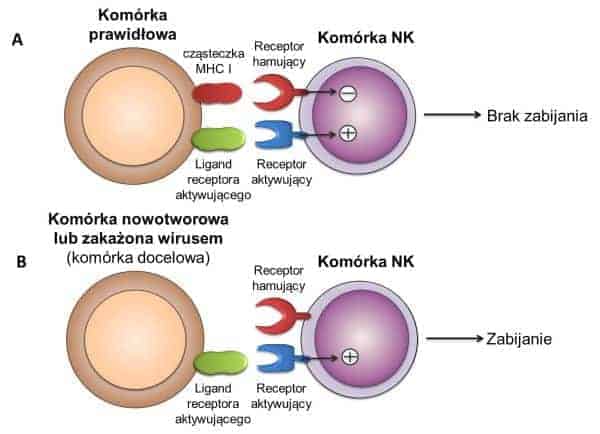
Rycina 1. Mechanizm rozpoznania przez komórki NK komórki prawidłowej (A) oraz komórki nowotworowej lub zakażonej wirusem (B). Jednym z ligandów dla receptorów hamujących jest cząsteczka głównego układu zgodności tkankowej (MHC) klasy I, obecna na niemal wszystkich komórkach prawidłowych. W wypadku, gdy komórki NK rozpoznają własne komórki prawidłowe, nie dochodzi do ich aktywacji. Często obserwowany jest brak cząsteczek MHC I na powierzchni komórek nowotworowych lub zakażonych wirusem, co prowadzi z kolei do aktywacji komórek NK i zabicia komórek docelowych.
TERAPIA ADOPTYWNA Z WYKORZYSTANIEM KOMÓREK NK
U chorych z nowotworami, liczba komórek NK oraz ich aktywność są często obniżone. Z tego względu podawanie chorym komórek NK jest atrakcyjną strategią wspomagającą leczenie nowotworów. Wyróżnia się dwa rodzaje terapii adoptywnej z wykorzystaniem komórek NK: autologiczną oraz alogeniczną. Terapia z użyciem autologicznych komórek NK polega na wyizolowaniu od chorego własnych komórek NK, ich hodowli, aktywacji oraz ekspansji w warunkach in vitro, a następnie ponownym podaniu choremu. Druga strategia z wykorzystaniem alogenicznych komórek NK polega na wyizolowaniu komórek NK od zdrowego dawcy, hodowli, aktywacji i ekspansji in vitro, a następnie podaniu choremu na nowotwór. Podawanie alogenicznych komórek NK często bywa skuteczniejsze od autologicznych komórek NK, szczególnie w wypadku nowotworów, które wykazują ekspresję cząsteczek MHC klasy I. Wynika to z faktu, że alogeniczne komórki NK są podawane z pewną niezgodnością w kontekście cząsteczek MHC klasy I. Alogeniczne komórki NK charakteryzują się większą aktywnością, ponieważ ich receptory hamujące, nie rozpoznając obcych cząsteczek MHC I na powierzchni komórek nowotworowych, nie dostarczają sygnału hamującego. (Rycina 2). Warto zwrócić uwagę, że alogeniczne komórki NK, pomimo niedopasowania w kontekście cząsteczek MHC I pomiędzy biorcą a dawcą, nie zabijają prawidłowych komórek biorcy. Wynika to z faktu, że brak sygnałów hamujących nie wystarcza do aktywacji komórek NK. Aby doszło do pełnej aktywacji, komórki NK muszą dodatkowo otrzymać sygnały aktywujące, pochodzące z rozpoznania odpowiednich antygenów na powierzchni komórek docelowych (Rycina 2).
Pionierskie badania przeprowadzone w 2002 roku u chorych z ostrą białaczką mieloblastyczną po raz pierwszy wykazały, jak ważną rolę odgrywają komórki NK w terapii nowotworów. Jedną z metod leczenia ostrej białaczki mieloblastycznej jest przeszczep szpiku od odpowiednio dobranego dawcy. Pięcioletnie przeżycia bez progresji choroby zaobserwowano u 100% chorych, którzy otrzymywali przeszczep szpiku, pomimo częściowej niezgodności cząsteczek MHC klasy I, w przeciwieństwie do 25% chorych, u których przeprowadzono przeszczep szpiku zgodny w kontekście cząsteczek MHC klasy I. Badanie to pokazało, że komórki NK dawcy, obecne w przeszczepianym szpiku, mogą pełnić korzystną rolę w eliminacji komórek nowotworowych u biorcy szpiku.
Od tamtej pory trwają intensywne badania nad optymalnym wykorzystywaniem komórek NK do leczenia nowotworów. Obecnie trwające badania kliniczne wykazują, że podawanie komórek NK pomimo pewnej niezgodności w układzie MHC klasy I, poprzedzone ekspansją komórek NK ex-vivo, jest bezpieczne.
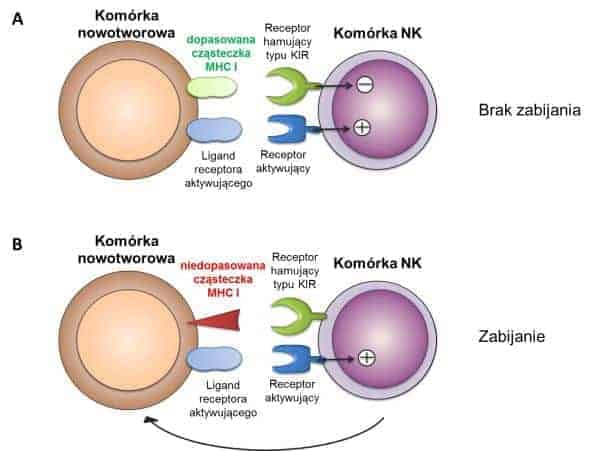
Rycina 2. Schematyczne przedstawienie aktywacji komórek NK w wypadku niezgodności w kontekście cząsteczek MHC klasy I. Cząsteczki MHC klasy I są rozpoznawane przez receptory hamujące typu KIR obecne na komórkach NK. (A) W wypadku zgodności w układzie MHC klasy I (podanie autologicznych komórek NK), cząsteczki MHC na powierzchni komórek są rozpoznawane przez receptory hamujące, co prowadzi do hamowania cytotoksyczności komórek NK i w rezultacie przeżycia komórki nowotworowej. (B) W sytuacji, w której występuje niezgodność w układzie MHC (podanie alogenicznych komórek NK), cząsteczki MHC na powierzchni komórek nie są rozpoznawane przez receptory hamujące, co prowadzi do aktywacji cytotoksyczności komórek NK i w rezultacie zabicia komórki nowotworowej.
STRATEGIE WZMACNIANIA TERAPII Z WYKORZYSTANIEM KOMÓREK NK
STYMULACJA CYTOKINAMI
Komórki NK u chorych na nowotwory mają obniżoną cytotoksyczność w porównaniu do komórek NK osób zdrowych. Cytotoksyczność komórek NK można jednak zwiększyć poprzez stymulację następującymi cytokinami: IL-2, IL-12, IL-15, IL-18, IL-21 oraz IFN typu I. Początkowo, aby wzmocnić cytotoksyczność komórek NK, cytokiny podawano ogólnoustrojowo, co jednak wpływało na wszystkie komórki układu odpornościowego i powodowało efekty niepożądane. Obecnie, w terapiach adoptywnych z wykorzystaniem komórek NK, cytokiny używane są głównie podczas hodowli i ekspansji komórek NK ex vivo. Najbardziej obiecującą i najczęściej stosowaną cytokiną jest IL-15. Dodatkowo, aby nasilić aktywację i proliferację komórek NK, hodowle ex vivo prowadzi się w obecności komórek wspomagających, tzw. feeder cells.
ZAHAMOWANIE RECEPTORÓW TYPU KIR
Jedną z nowszych strategii wzmocnienia działania przeciwnowotworowego komórek NK jest zablokowanie receptorów hamujących typu KIR przy użyciu przeciwciał monoklonalnych anty-KIR, takich jak lirilumab. W trwających badaniach klinicznych przeciwciała anty-KIR są testowane w monoterapii oraz w połączeniu z innymi terapiami (https://clinicaltrials.gov/ct2/results?term=anti-KIR+NK+cells&Search=Search). Wyniki dotychczasowych badań wskazują, że stosowane przeciwciała anty-KIR są bezpieczne i nie powodują procesów autoimmunizacji. Wyjaśnieniem tego zjawiska jest najprawdopodobniej fakt, że komórki NK do pełnej aktywacji potrzebują sygnałów aktywujących, a nie tylko braku sygnału z receptorów hamujących.
LINIE WYWODZACE SIĘ Z KOMÓREK NK
Równolegle z opisanymi strategiami terapeutycznymi, inną atrakcyjną opcją do zastosowania w terapii adoptywnej jest wykorzystanie linii komórkowych wywodzących się z komórek NK. Spośród kilku linii komórkowych, takich jak: NK92, NKL, KYHG-1 oraz NKG, najczęściej testowana w badaniach klinicznych jest linia NK92. Komórki NK92 wykazują ekspresję kilku receptorów aktywujących oraz nie mają na swojej powierzchni receptorów hamujących typu KIR. Z tego względu komórki NK92 wykazują znaczącą cytotoksyczność względem różnych komórek nowotworowych. Komórki NK92, zanim zostaną podane pacjentom, muszą być napromieniowane, aby zapobiec ich namnażaniu się w organizmie chorego. Procedura ta jednak nie upośledza ich zdolności do zabijania komórek nowotworowych. Zaletą stosowania linii komórek NK w stosunku do komórek pierwotnych jest ich łatwa dostępność i możliwość namnożenia na dużą skalę, co znacząco obniża koszt terapii. Ponadto, linie komórek NK mogą być wydajnie modyfikowane genetycznie. Komórki NK92 są obecne testowane w fazie I i II badań klinicznych pod komercyjną nazwą Neukoplast.
CHIMERYCZNE RECEPTORY ANTYGENOWE (CAR)
W ostatnich latach, w immunoterapii próbuje się również wykorzystać genetycznie modyfikowane komórki NK. Jednym z najnowszych typów modyfikacji jest wprowadzenie do komórek NK genów kodujących chimeryczne receptory antygenowe (CAR). Receptory CAR składają się z części rozpoznającej antygen obecny na komórkach nowotworowych oraz wewnątrzkomórkowej części przekazującej sygnały aktywujące komórki (więcej informacji na temat CAR w poprzednim tekście Bazy wiedzy pt.: „Chimeryczne receptory antygenowe”). Najbardziej zaawansowanie badania są prowadzone z wykorzystaniem limfocytów T modyfikowanych CAR. Niemniej jednak, komórki NK, wykazując funkcje cytotoksyczne, są także atrakcyjnymi kandydatami do ekspresji CAR. Alogeniczne komórki NK, w przeciwieństwie do limfocytów T, nie powodują wystąpienia ciężkich objawów niepożądanych, nawet kiedy dawca oraz chory z nowotworem biorca nie są zgodni w kontekście cząsteczek MHC klasy I. W trwających badaniach klinicznych, komórki NK92 wykazujące ekspresję CAR anty-CD7 są testowane u chorych z ostrą białaczką mieloblastyczną oraz nowotworami wywodzącymi się z limfocytów T.
CYTOTOKSYCZNOŚĆ KOMÓRKOWA ZALEŻNA OD PRZECIWCIAŁ
Komórki NK są uznawane za komórki odgrywające kluczową rolę w cytotoksyczności komórkowej zależnej od przeciwciał (ADCC), a zatem przyczyniają się do efektu terapeutycznego przeciwciał monoklonalnych stosowanych w immunoterapii. Komórki NK wykazują ekspresję receptora CD16 (FcγRIIIa), przez który wiążą fragment Fc przeciwciał klasy IgG. Związanie przez CD16 przeciwciała rozpoznającego specyficznie antygen na powierzchni komórek nowotworowych indukuje aktywację i degranulację komórek NK. Jest to jeden z głównych mechanizmów efektorowych, przez które przeciwciała monoklonalne niszczą komórki nowotworowe (Rycina 3).
BI- ORAZ TRISPECYFICZNE PRZECIWCIAŁA
Odmiennym podejściem, mającym na celu poprawę skuteczności terapii z wykorzystaniem komórek NK, jest tworzenie bi-, a także tri-specyficznych przeciwciał angażujących komórki o zdolnościach cytotoksycznych, tzw. BiKE oraz TriKE. Tego typu przeciwciała rozpoznają receptory aktywujące na powierzchni komórek NK, zazwyczaj CD16, i jeden lub więcej antygenów specyficznych dla komórek nowotworowych. Technologia ta ułatwia napływ komórek efektorowych w bezpośrednie sąsiedztwo komórek nowotworowych, pozwalając na bardzo bliski kontakt pomiędzy komórką NK a komórką docelową i jednocześnie powoduje aktywację komórek NK
DALSZE PERSPEKTYWY ZASTOSOWANIA KOMÓREK NK W IMMUNOTERAPII
Badania nad biologią komórek NK pozwoliły lepiej zrozumieć ich ogromny potencjał terapeutyczny. Co najważniejsze, obecnie dysponujemy już narzędziami, które pozwalają na próby wykorzystania tego potencjału w klinice. W niedalekiej przyszłości klika produktów stworzonych w oparciu o komórki NK zostanie poddanych wieloośrodkowym badaniom klinicznym.
 Komórki NK („naturalni zabójcy”) – zastosowanie w immunoonkologii
Komórki NK („naturalni zabójcy”) – zastosowanie w immunoonkologii
Autorzy: Marta Siernicka, Małgorzata Firczuk, Magdalena Winiarska
źródło: www.stream.wum.edu.pl
 Komórki NK („naturalni zabójcy”) – zastosowanie w immunoonkologii
Komórki NK („naturalni zabójcy”) – zastosowanie w immunoonkologii