Co to są punkty kontrolne układu odpornościowego?
Odporność swoistą stanowią komórki i ich receptory odpowiedzialne za specyficzne rozpoznanie obcych antygenów i reakcję na ewentualne zagrożenia. Takie zagrożenia mogą stanowić zarówno zewnątrzpochodne patogeny, jak i własne komórki o nieprawidłowej budowie lub funkcji, na przykład komórki nowotworowe.
Rozpoznanie obcych antygenów zachodzi w wyniku prezentacji fragmentów tych antygenów (peptydów) w połączeniu z cząsteczkami głównego układu zgodności tkankowej (MHC) swoistym receptorom antygenowym limfocytów T (TCR). Dodatkowo, w ramach ścisłej kontroli swoistej odpowiedzi immunologicznej, limfocyt T otrzymuje zestaw sygnałów kostymulujących lub hamujących, dostarczanych poprzez specjalne receptory i ich ligandy, zwane „punktami kontrolnymi układu odpornościowego”. Taka złożona aktywacja pozwala na uniknięcie odpowiedzi skierowanej przeciwko antygenom własnym obecnym na komórkach prawidłowych. Dzięki obecności punktów kontrolnych, układ odpornościowy pozostaje w stanie równowagi, jednocześnie efektywnie eliminując patogeny i zachowując tolerancję dla antygenów własnych. Zbyt mocna odpowiedź immunologiczna na patogeny lub zmienione antygeny własne może powodować uszkodzenie tkanek i choroby autoimmunologiczne.
Przeciwnowotworowa odpowiedź immunologiczna
Limfocyty T potrafią rozpoznawać zmienione antygeny (tzw. neoantygeny) prezentowane na powierzchni komórek nowotworowych, co w konsekwencji prowadzi do zniszczenia komórek nowotworowych i zahamowania wzrostu guza. Dowiedziono, że odpowiedź immunologiczna związana z limfocytami T wpływa na przeżycie pacjentów i może stanowić czynnik prognostyczny odpowiedzi na immunoterapię. Na przykład, w raku jelita grubego intensywny naciek limfocytów T (tzw. wskaźnik immunologiczny, z ang. immunoscore) w tkankach zmienionych nowotworowo jest korzystnym czynnikiem prognostycznym dla pacjenta.
Niemniej, przewlekła ekspozycja na antygen powoduje tzw. „wyczerpanie” komórek układu odpornościowego, w tym limfocytów T. Takie „wyczerpane” limfocyty T charakteryzuje zaburzenie zdolności do proliferacji i wytwarzania cytokin, jak również podwyższona ekspresja receptorów hamujących odpowiedź immunologiczną, tzw. immunologicznych punktów kontrolnych. Receptory te wiążą się do odpowiednich ligandów znajdujących się na powierzchni komórek nowotworowych oraz innych komórek obecnych w mikrośrodowisku guza. Poprzez te punkty kontrolne komórki nowotworowe są w stanie blokować przeciwnowotworowe limfocyty T, co w konsekwencji prowadzi do ucieczki komórek nowotworowych spod nadzoru immunologicznego. Najważniejsze punkty kontrolne układu odpornościowego opisano w Tabeli 1.
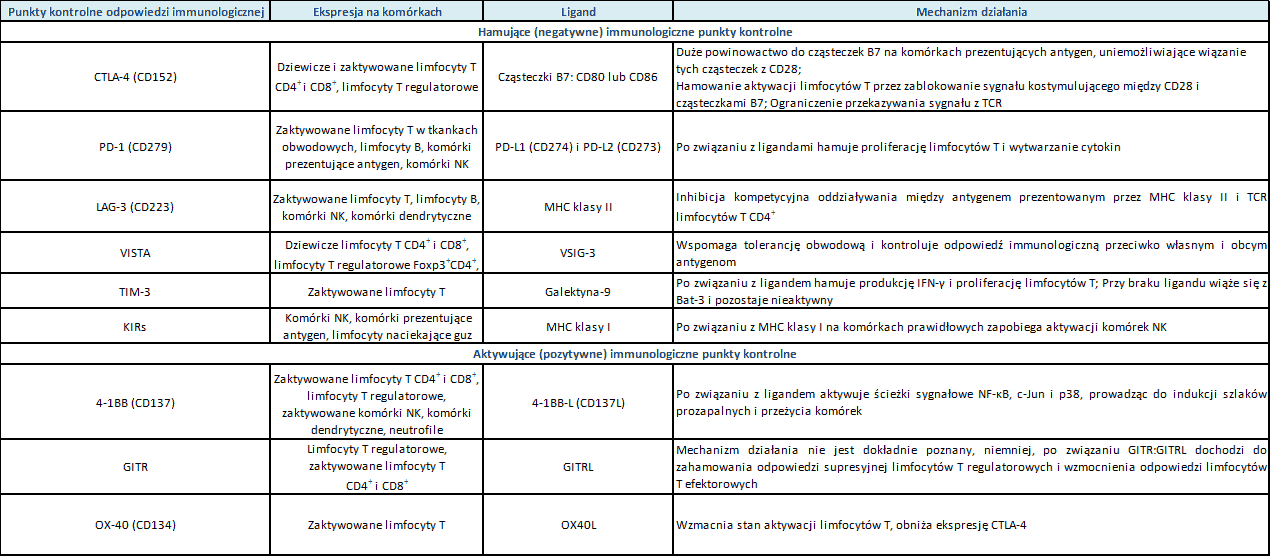
Tabela 1. Charakterystyka punktów kontrolnych układu odpornościowego (kliknij na tabelę, aby powiększyć)
Blokada punktów kontrolnych układu odpornościowego za pomocą przeciwciał monoklonalnych
W ostatnich latach zahamowanie aktywności negatywnych punktów kontrolnych układu odpornościowego stało się bardzo atrakcyjną strategią leczenia nowotworów. Najczęściej stosowane są: blokada receptora CTLA-4 oraz blokada wiązania pomiędzy cząsteczkami PD-1 i PD-L1. Dotychczas w onkologii znalazło zastosowanie sześć przeciwciał monoklonalnych blokujących sygnały pochodzące z punktów kontrolnych układu odpornościowego:
- 1. Ipilimumab – inhibitor CTLA-4,
- 2. Nivolumab i pembrolizumab – inhibitory PD-1,
- 3. Atezolizumab, avelumab, i durvalumab – inhibitory PD-L1.
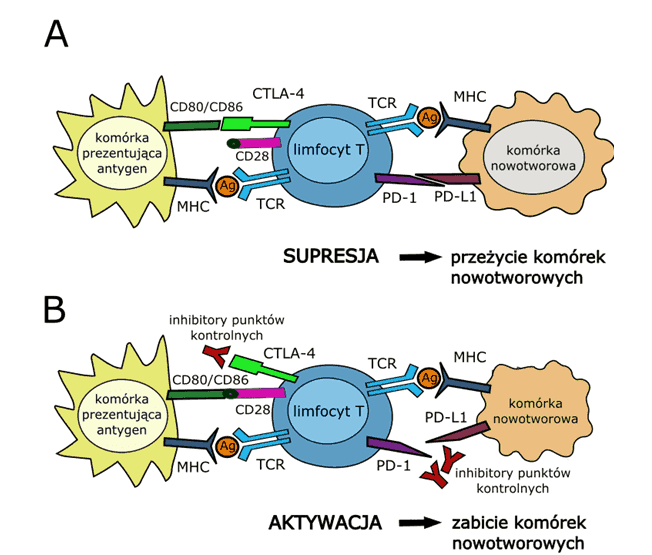
Na rycinie 1 przedstawiono mechanizmy immunosupresji, w których pośredniczą negatywne receptory CTLA-4- i PD-1 oraz stymulacja przeciwnowotworowych limfocytów T za pośrednictwem hamujących przeciwciał monoklonalnych.
Rycina 1. (A) Mechanizm działania punktów kontrolnych hamujących odpowiedź immunologiczną. CTLA-4 z dużym powinowactwem wiąże się z cząsteczkami CD80 i CD86 na komórce prezentującej antygen, uniemożliwiając ich wiązanie z cząsteczką kostymulujacą CD28, co prowadzi do wytłumienia aktywacji limfocytu T. Związanie PD-1 na limfocycie T z jego ligandem PD-L1 na komórce nowotworowej hamuje aktywację odpowiedzi immunologicznej. (B) Zastosowanie inhibitorów punktów kontrolnych umożliwia oddziaływanie CD80/86 z cząsteczką kostymulującą CD28 oraz blokuje oddziaływanie PD-1 z PD-L1, co w konsekwencji prowadzi do aktywacji limfocytu T i zabicia komórek nowotworowych.
Indukcja przeciwnowotworowej odpowiedzi immunologicznej wymaga swoistej aktywacji klonów limfocytów T skierowanych przeciwko antygenom nowotworowym. Antygeny pochodzące z komórek nowotworowych (neoantygeny) wychwytywane są przez komórki prezentujące antygen i w połączeniu z cząsteczkami MHC prezentowane receptorom TCR na limfocytach T. Dodatkowo, aktywacja limfocytów T wymaga sygnałów kostymulujących pochodzących od komórki prezentującej antygen. Sygnały te przekazywane są poprzez oddziaływanie pomiędzy receptorem CD28 a jego ligandami CD80 i CD86. Niemniej, obecny na limfocytach T receptor CTLA-4 wykazuje znacznie większe powinowactwo do tych ligandów. W ten sposób CTLA-4 wytłumia proces aktywacji limfocytu T, powodując zahamowanie odpowiedzi przeciw komórkom nowotworu (Rycina 1A). Zastosowanie przeciwciała anty-CTLA-4, ipilimumabu, powoduje zablokowanie cząsteczki hamującej aktywność limfocytów T i aktywację odpowiedzi przeciwnowotworowej (Rycina 1B).
Drugim ważnym mechanizmem hamującym przeciwnowotworową aktywność limfocytów T jest przekazywanie sygnału poprzez cząsteczki PD-1/PD-L1. Główna rola receptora PD-1 polega na hamowaniu proliferacji limfocytów T i wytwarzania cytokin. Ligandami dla PD-1 są cząsteczki PD-L1 i PD-L2, w dużej ilości obecne na powierzchni komórek nowotworowych oraz innych komórek obecnych w mikrośrodowisku guza. Związanie PD-L1 i/lub PD-L2 z receptorem PD-1 powoduje zahamowanie przekazywania sygnałów aktywujących limfocyty T (Rycina 1A), obniżenie ekspresji cytokin prozapalnych i cząsteczek antyapoptotycznych, jak również prowadzi do „wyczerpania” limfocytów T. Przeciwciała anty-PD-1 blokują interakcję receptora PD-1 z jego ligandami, co przyczynia się do wzmocnienia cytotoksyczności limfocytów T i zwiększonej produkcji cytokin. Przeciwciała anty-PD-L1 blokują oddziaływanie pomiędzy PD-L1 i PD-1 (Rycina 1B).
Zastosowanie inhibitorów punktów kontrolnych w onkologii
Skuteczność działania przeciwciał monoklonalnych skierowanych przeciwko punktom kontrolnym hamującym odpowiedź immunologiczną została potwierdzona w leczeniu takich nowotworów jak czerniak złośliwy, niedrobnokomórkowy rak płuca, rak nerkowokomórkowy, rak jelita grubego i rak pęcherza moczowego, neuroendokrynny rak skóry czy chłoniak Hodgkina. Najlepsze wyniki uzyskano w leczeniu czerniaka.
Zastosowanie przeciwciał anty-PD-1 w leczeniu czerniaka złośliwego pokazało, że 33–40% chorych długotrwale odpowiada na leczenie, a u 15-20% zaobserwowano całkowite wyleczenie. Niestety, znaczna część chorych nie reaguje na terapię, dlatego wciąż istnieje pilna potrzeba udoskonalania obecnych i opracowania nowych strategii leczenia. Jednym z rozwiązań może być terapia skojarzona, polegająca na zastosowaniu inhibitorów punktów kontrolnych skierowanych na więcej niż jedną cząsteczkę docelową, np. przeciwciał anty–PD-1/anty–PD-L1 razem z przeciwciałem anty–CTLA-4. Takie podejście okazało się być skuteczne w leczeniu czerniaka w zaawansowanym stadium. Obecnie trwają zaawansowane badania kliniczne nad skutecznością terapii skojarzonej z użyciem inhibitorów punktów kontrolnych przeciw CTLA-4 i PD-1 lub PD-L1 w immunoterapii raka piersi.
Niestety, zastosowanie przeciwciał monoklonalnych anty-CTLA-4 i anty-PD-1 w terapii kombinowanej pomimo, iż jest stosunkowo skuteczne, wiąże się również ze znaczną toksycznością. Dodatkowo, nierozwiązany pozostaje problem niewrażliwości znacznej części pacjentów na tą terapię. W celu pokonania tych barier, stosowane są nowoczesnemetody leczenia łączące inhibitory punktów kontrolnych z innymi terapiami przeciwnowotworowymi8.
Połączenie inhibitorów punktów kontrolnych z konwencjonalnymi metodami leczenia nowotworów
Obecnie, w badaniach klinicznych testowane jest użycie inhibitorów punktów kontrolnych wraz z tradycyjnymi metodami leczenia, takimi jak radioterapia, chemioterapia czy resekcja guza9. Wykazano, że zablokowanie punktów kontrolnych układu odpornościowego jest stosunkowo bezpieczne w połączeniu z chirurgicznym usunięciem guza10. Ponadto, wykorzystanie niedawno poznanych właściwości immunomodulujących radioterapii, wzmacniających układ odpornościowy, w połączeniu z zastosowaniem inhibitorów punktów kontrolnych może być obiecującą strategią leczenia7. Aktywację przeciwnowotworowej odpowiedzi immunologicznej za pomocą przeciwciał monoklonalnych skierowanych wobec punktów kontrolnych można również wzmocnić poprzez skojarzenie z chemioterapią. Chemioterapeutyki stosowane w leczeniu nowotworów swoją aktywność przeciwnowotworową zawdzięczają częściowo stymulacji układu odpornościowego pacjenta. Następuje to poprzez dostarczenie antygenów nowotworowych pochodzących z umierających komórek nowotworowych, rekrutację komórek układu odpornościowego do mikrośrodowiska nowotworu i supresję limfocytów T regulatorowych. Ponieważ zastosowanie jedynie leczenia chemoterapeutykami jest niewystarczające do skutecznej aktywacji przeciwnowotworowej odpowiedzi immunologicznej, połączenie tego typu terapii z równoczesnym zablokowaniem punktów kontrolnych wydaje się być obiecującym podejściem w terapii nowotworów.
Połączenie blokady punktów kontrolnych z terapiami biologicznymi
Inną, obiecującą strategią przeciwnowotworową jest zastosowanie inhibitorów punktów kontrolnych układu odpornościowego w połączeniu z lekami biologicznymi, takimi jak: przeciwciała monoklonalne, przeciwciała sprzężone z toksynami, cytokiny, leki antyangiogenne, adoptywny transfer limfocytów T i komórek NK, przeciwciała o podwójnej swoistości, szczepionki przeciwnowotworowe, wirusy onkolityczne. Obecnie, większość z tych podejść terapeutycznych jest weryfikowana w badaniach klinicznych.

Autorzy: mgr Katsiaryna Marhelava, dr Małgorzata Bajor, dr Małgorzata Firczuk, dr hab. Radosław Zagożdżon
źródło: www.stream.wum.edu.pl